Benzen (C6H6) được biết là 1 trong hiđrocacbon thơm phức với rất nhiều phần mềm vô công nghiệp và cuộc sống. Không chỉ vậy, Benzen còn là 1 trong dung môi cơ học được dùng khá thịnh hành. Nó sở hữu cấu hình không giống với metan, etylen hoặc axetylen. Vậy cấu trúc phân tử của benzen là gì? Những đặc điểm vật lý cơ và chất hóa học của benzen là gì? Chúng tao tiếp tục bên nhau dò la hiểu bọn chúng vô nội dung bài viết ngày hôm nay nhé!
Khái niệm benzen là gì?
Benzen là 1 trong hydrocacbon thơm phức không nhiều tan nội địa nhưng dễ dàng tan vô dầu khoáng, dầu động thực vật, dung môi cơ học,… nhất là hóa học lớn, tô, vecni, dầu hắc, cao su thiên nhiên và vật liệu bằng nhựa đàng, vật liệu bằng nhựa kêu ca,…
Bạn đang xem: Benzen: Đặc điểm tính chất, cấu tạo, ứng dụng và bài tập
Trong công nghiệp, benzen là nguyên liệu dùng làm tổ hợp nhiều hợp ý hóa học hữu cơ như anilin, clo benzen, nitrobenzen, phenol,… dùng để dung môi hòa tan những hóa học lớn.
Kể kể từ trong thời gian 1970, benzen đã trở nên giới hạn dùng vô công nghiệp. Tại nước Việt Nam, việc cấm dùng hóa hóa học benzen vô công nghiệp đang được quy ấn định bên trên số 108 LB/QĐ.
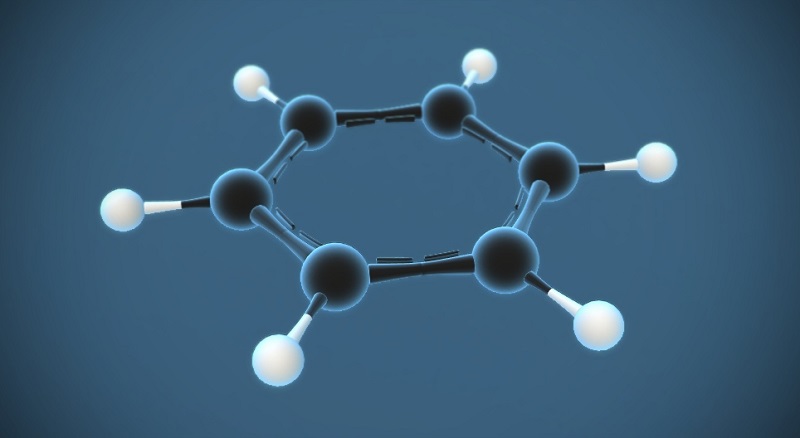
Công thức phân tử của benzen là: C6H6.
- Phân tử khối: 78
- Cấu tạo nên phân tử:
.jpg)
Tính hóa học vật lý cơ của benzen
Benzen (C6H6) là hóa học lỏng ko màu sắc, nhẹ nhõm rộng lớn nước và ko tan nội địa. Benzen rất có thể hòa tan nhiều hóa học như: Dầu ăn, cao su thiên nhiên, nến, iot... và nhiều dung môi cơ học không giống. Benzen là độc hại và dễ dàng cháy.
C6H6 sở hữu lượng riêng rẽ 0,8786 g/cm3 hóa học lỏng, rét chảy ở 5,5 phỏng C, sôi ở 80,1 phỏng C. (Wikipedia)
Tính hóa chất của benzen
Tính hóa học của Benzen sở hữu các phản xạ chất hóa học đặc thù như cháy, thế và nằm trong. C6H6 vừa phải sở hữu phản xạ thế vừa phải sở hữu phản xạ nằm trong, tuy nhiên phản xạ nằm trong xẩy ra khó khăn rộng lớn đối với C2H4 và C2H2.

Benzen dễ dàng cháy
Giống giống như các hydrocacbon không giống, benzen cháy vô oxy muốn tạo rời khỏi CO2 và tương đối nước. Tuy nhiên, Khi benzen cháy vô bầu không khí, ngoài CO2 và tương đối nước còn dẫn đến muội kêu ca.
2C6H6 + 15O2 (nhiệt độ) → 12CO2 + 6H2O
Phản ứng thế với brom (phản ứng thế)
Đặc điểm cấu trúc của benzen: Khi đun rét láo hợp ý benzen với brom, xuất hiện bột Fe thấy gray clolor đỏ chót của brom bị thất lạc lên đường và sở hữu khí hidro bromua cất cánh rời khỏi.
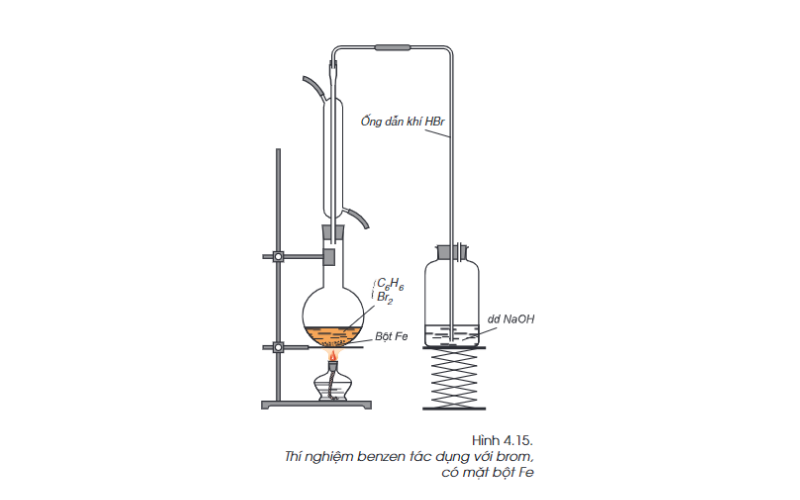
C6H6(l) + Br2(l) (t, bột Fe) → C6H5Br (chất lỏng ko màu) + HBr(k)
Trong phản xạ bên trên, nguyên vẹn tử hidro vô phân tử benzen được thay vì nguyên vẹn tử brom.
Phản ứng nằm trong benzen
Benzen ko phản xạ với hỗn hợp Br2, minh chứng benzen khó khăn nhập cuộc phản xạ nằm trong như C2H4 và C2H2. Tuy nhiên ở sức nóng phỏng và ĐK xúc tác phù hợp, C6H6 nhập cuộc phản xạ cùng theo với một trong những hóa học, ví như H2, ...
C6H6 + 3H2 (t, Ni) → C6H12
XÂY DỰNG NỀN TẢNG TOÁN HỌC VỮNG CHẮC CHO TRẺ TỪ NHỎ VỚI ĐA PHƯƠNG PHÁP DẠY HỌC TÍCH CỰC, CHI PHÍ CỰC RẺ CHƯA ĐẾN 2K/NGÀY CÙNG MONKEY MATH.
![]()
Điều chế benzen như vậy nào?
Trong cuộc sống, benzen được dùng thật nhiều vô phát hành dược phẩm hoặc những hóa học cần thiết đáp ứng nhu yếu của nhân loại. Vậy benzen được pha chế như vậy nào? Hãy xem thêm ngay lập tức nội sử dụng sau đây:
-
Điều chế benzen kể từ axetilen
Phản ứng trùng khớp axetilen xẩy ra Khi xúc tác là C và nung ở sức nóng phỏng 600 phỏng C.
3CH = CH → C6H6
-
Điều chế benzen kể từ axit benzoic
C6H5COOH + NaOH → C6H6 + Na2CO3
-
Điều chế benzen kể từ chưng đựng vật liệu bằng nhựa kêu ca đá
-
Điều chế kể từ xiclohexan dùng xúc tác Pt và đun nóng
C6H12 → C6H6 + 3H2
-
Điều chế kể từ n - hexan xúc tác và đun nóng
C6H14 → C6H6 + 4H2
Xem thêm:
- Hợp hóa học cơ học là gì? Khái niệm về hợp ý hóa học cơ học và chất hóa học hữu cơ
- Khí metan là gì? Trạng thái ngẫu nhiên, đặc điểm, phần mềm và cơ hội điều chế
Các phần mềm của benzen
Trong công nghiệp, benzen được dùng vô một trong những ngành công nghiệp hóa hữu cơ. Trong khi, bọn chúng còn được dùng nhằm tổ hợp monome vô phát hành polyme sử dụng mang đến vật liệu bằng nhựa, cao su thiên nhiên và sợi.
.jpg)
Benzen cũng thông thường được dùng làm thực hiện dung môi hòa tan những chất như dầu mỡ, cao su thiên nhiên, vecni. Dùng nhằm tẩy dầu mỡ mang đến xương, sợi, vải vóc, len, dạ, giặt thô, tẩy dầu mỡ mang đến tấm sắt kẽm kim loại. Trong khi, những công cụ sở hữu vết dầu mỡ thông thường sử dụng benzen nhằm rửa sạch.
Benzen còn được dùng làm chế tạo nên những hóa học vô sản xuất như nitrobenzene, anilin, phenol, tổ hợp dung dịch nhuộm, dược phẩm, dung dịch trừ thâm thúy, phát hành cumene, axeton và phenol.
Benzen độc không? Hình ảnh hưởng trọn cho tới sức mạnh nhân loại như vậy nào?
Ngoài những ứng dụng vô nằm trong rộng lớn phía trên, benzen còn được nghe biết là một hóa học đặc biệt độc so với sức mạnh và năng lực tạo nên ung thư của bọn chúng là đặc biệt cao. Những người bị ngộ độc benzen cung cấp tính tiếp tục gặp gỡ những triệu hội chứng sau:
.jpg)
-
Nhức đầu, đau đầu và chóng mặt, buồn thổ, lú lẫn lộn.
-
Mất ý thức, mê man, hay quên.
-
Giảm thính lực.
-
Viêm phổi.
-
Bỏng, viêm kết mạc, màng mắt, loà màu sắc.
-
Viêm gan dạ nhiễm độc.
-
Viêm cầu thận.
-
Tổn thương tim mạch
Khi bị nhiễm độc mạn tính sẽ sở hữu 2 quá trình chủ yếu. Đó là:
-
Giai đoạn phát khởi khiến cho tất cả chúng ta bị: rối loàn hấp thụ, rối loàn thần kinh trung ương, rối loàn huyết học tập.
-
Trong thời kỳ toàn phân phát tiếp tục xuất hiện tại những triệu hội chứng như chảy ngày tiết, thiếu thốn ngày tiết, hạn chế bạch huyết cầu,…
Chúng tao rất có thể bị nhiễm độc benzen trải qua những đàng sau:
-
Trong đồ ăn thức uống, benzen được dùng làm bảo vệ đồ ăn thức uống, nhất là nước ngọt đóng góp chai.
-
Benzen sở hữu vô bầu không khí Khi tất cả chúng ta dùng nhằm phát hành công nghiệp khi bại khí tiếp tục cất cánh tương đối. Hoặc vô hóa học thải của phương tiện đi lại giao thông vận tải dùng nhiên liệu hóa thạch.
Đối với những người dân làm việc khai quật dầu lửa, người làm việc phát hành vật vật liệu bằng nhựa, người công nhân phát hành và chế đổi thay vật vật liệu bằng nhựa,... nhằm đáp ứng sức mạnh, chúng ta nên thăm hỏi nhà tù bác bỏ sĩ thông thường xuyên, lịch 6 mon nên tổ chức triển khai đánh giá một chuyến. Nếu phân phát hiện tại mặc dù có một tình huống ngộ độc thì cần tổ chức triển khai nhà tù toàn bộ những người công nhân bị bầy nhiễm. Về những hiện tượng lạ lâm sàng, lưu ý biểu hiện toàn thân: Cân nặng nề, thức ăn, ngủ nghỉ… Trong khi, cần thiết phân phát hiện tại tín hiệu chảy máu.
Bài luyện về benzen SGK Hóa học tập 9 kèm cặp điều giải
Dựa vô những kỹ năng bên trên chúng ta có thể tận dụng tối đa nhằm giải một trong những bài bác luyện vô SGK Hóa học tập lớp 9:

Bài luyện 1 (Trang 125 SGK Hóa học tập 9)
Cấu tạo nên quan trọng đặc biệt của phân tử benzen là:
a) Phân tử sở hữu 6 vòng cạnh.
b) Phân tử sở hữu phụ vương links song.
Xem thêm: Quả bóng Vàng 2023 khi nào công bố? Diễn ra ở đâu? Messi có tỷ lệ thắng cao nhất?
c) Phân tử sở hữu 6 vòng cạnh chứa chấp phụ vương links song xen kẹt phụ vương links đơn.
d) Phân tử sở hữu 6 vòng cạnh chứa chấp phụ vương links song và phụ vương links đơn.
Hãy lựa chọn câu đích nhất trong số câu bên trên.
Gợi ý đáp án:
Chọn câu c) đích.
Bài luyện 2 (Trang 125 SGK)
Một số học viên viết lách công thức cấu trúc của benzen như sau:
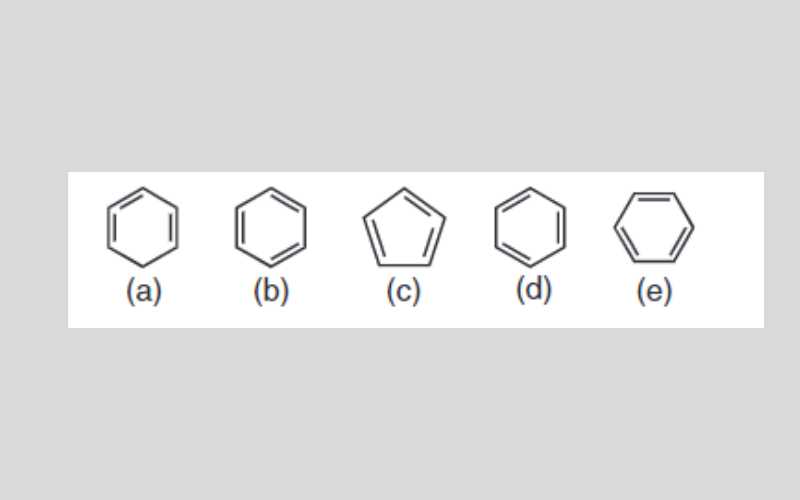
Hãy cho thấy công thức này viết lách đích, viết lách sai, bên trên sao?
Gợi ý đáp án:
Công thức cấu trúc đích của benzen: b), d), e)
(a) sai vì như thế 2 links Pi ở cả hai nguyên vẹn tử C ngay lập tức kề nhau (sai về địa điểm links đôi)
(c) sai vì như thế sở hữu 5 nguyên vẹn tử C
Bài luyện 3 (Trang 125 SGK)
Cho benzen ứng dụng với brom dẫn đến brombenzen:
a) Viết phương trình chất hóa học (có ghi rõ ràng ĐK phản ứng).
b) Tính lượng benzen cần thiết dùng làm pha chế 15,7g brombenzen. thạo hiệu suất phản xạ đạt 80%.
Gợi ý đáp án:
a) Phương trình phản ứng:
C6H6 + Br2 (Fe)→ C6H5Br + HBr.
b) nC6H5Br = 15,7 / 157 = 0,1 mol.
Theo phương trình: nC6H6 = nC6H5Br = 0,1 mol.
Do H = 80% nên:
mC6H6 = 0,1. 78 : 80% = 9,75(g)
Bài luyện 4 (Trang 125 SGK)
Hãy cho thấy hóa học này trong số hóa học tại đây rất có thể làm mất đi màu sắc hỗn hợp brom. Giải quí và viết lách phương trình chất hóa học (nếu có).
a) C6H6.
b) CH2 = CH – CH = CH2.
c) CH3 – C≡ CH.
d) CH3 – CH3.
Gợi ý đáp án:
Chỉ sở hữu hóa học b) và c) làm mất đi màu sắc hỗn hợp brom. Vì vô phân tử sở hữu links song và links phụ vương tương tự động như C2H4 và C2H2.
b) CH2 = CH – CH = CH2 + 2Br2 (dd)→ CH2Br – CHBr – CHBr – CH2Br.
Hoặc: CH2 = CH – CH = CH2 + Br2 → CH2Br – CHBr – CH = CH2
c) CH3 – C ≡ CH + 2Br2 → CH3 – CBr2 – CHBr2
Hoặc CH3 – C ≡ CH + Br2 → CH3 – CBr = CHBr
Bài luyện về Benzen chất hóa học nhằm học viên tự động luyện
Bài 1: Chất này tại đây sở hữu năng lực nhập cuộc phản xạ trùng khớp tạp polime?
A. benzen B. toluen C. 3 propan D. stiren
Bài 2: Chất này tại đây làm mất đi màu sắc hỗn hợp KMnO4 ở sức nóng phỏng thường?
A. benzen B. toluen C. propan D. stiren
Bài 3: Benzen ứng dụng với Br2 theo tỷ trọng mol 1 : 1 (có mặt mũi bột Fe), chiếm được sẩn phẩm cơ học là
A.C6H6Br2 B. C6H6Br6
C. C6H5Br D. C6H6Br4
Bài 4: Benzen ứng dụng với H2 dư xuất hiện bột Ni xúc tác, thu được
A. hex-1-en B. hexan
C. 3 hex-1-in D. Xiclohexan
Bài 5: Phản ứng Benzen ứng dụng với clo tạo nên C6H6Cl6 xảy rời khỏi vô điều kiện:
A. Có bột Fe xúc tác B. Có ánh sánh khuyếch tán
C. Có dung môi nước D. Có dung môi CCl4
Bài 6: Dãy bao gồm những group thế thực hiện mang đến phản xạ thế vô vòng benzen đơn giản và dễ dàng rộng lớn và ưu tiên địa điểm m- là:
A. -CnH2n+1, -OH, -NH2 B. –OCH3, -NH2, -NO2
C. –CH3, -NH2, -COOH D. –NO2, -COOH, -SO3H
Bài 7: Phản ứng này tại đây ko xảy ra:
A. Benzen + Cl2 (as) B.Benzen + H2 (Ni, tº)
C. Benzen + Br2 (dd) D.Benzen + HNO3 /H2SO4(đ)
Bài 8: Cho benzen + Cl2 (as) tao chiếm được dẫn xuất clo A. Vậy A là:
A.C6H5Cl B.p-C6H4Cl2 C.C6H6Cl6 D.m-C6H4Cl2
Bài 9: Cho benzen ứng dụng với lượng dư HNO3 đặc sở hữu xúc tác H2SO4 đặc nhằm pha chế nitrobenzen. Khối lượng Nitrobenzen pha chế được kể từ 19,5T benzen (hiệu suất phản xạ 80%) là bao nhiêu?
Xem thêm: Etrip4u tư vấn: Nên hủy vé máy bay trước bao lâu ?
Bài 10: Chất X là đồng đẳng của benzen, sở hữu công thức giản dị và đơn giản nhất là C3H8 .Công thức phân tử của của X là gì?
Bài 11: Đốt cháy trọn vẹn ankybenzen X chiếm được 7,84 lít CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của X là bao nhiêu?
Trên phía trên Monkey vẫn trình làng với chúng ta về đặc điểm vật lý cơ, đặc điểm chất hóa học, cấu trúc phân tử của Benzen C6H6. Hy vọng nội dung bài viết này tiếp tục giúp cho bạn làm rõ rộng lớn. Nếu bạn phải dò la hiểu thêm thắt về nhiều môn học tập không giống rất có thể truy vấn vô trang web để sở hữu thêm thắt nhiều kỹ năng thú vị nhé!








Bình luận